pHとは?
pHとは?
pHとは?
pH(「ペーハー」、「ピーエッチ」)とは水素イオン濃度の略称であり、溶液中の水素イオンの濃度を指します。具体的には溶液中1L中の水素イオンのモル濃度の逆数の常用対数から求め、一般には
pH = ‐log [H+] … ※1
として定義されます。
※「水素イオン」の濃度であり、「水素」の濃度ではありません。
純粋な水は水分子のまま安定しているわけではなく、常に下記のような別れ(「電離」)と出会い(「反応」)を繰り返しています。

このとき生じているH+の濃度が高いか低いかを示す尺度がpHです。水中のpHは溶けている物質や温度に応じて様々な値をとります。
pHの最大と最小
※2に登場しているH+とOH–は、両者の濃度を掛けた値が一定となります。

上記の式は、片方が濃くなれば、もう片方が薄くなる関係という関係を表しています。
また、※1の式を用いてpHの値に換算すると、

と表すことができ、普通は両者を足して14が最大となります。
酸性とアルカリ性と中性
pHの次に来る数字は、下記に示すように分母の右肩からとられています。
pHの値が小さいほど、分数の分母は小さくなり、H+の濃度は濃くなっていきます。
| pHの値 | pH1 | pH7 | pH14 |
|---|---|---|---|
| 数字の由来 | 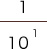 |
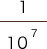 |
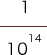 |
| 具体的な数値 | = 0.1 mol/L | 0.0000001 mol/L | 0.00000000000001 mol/L |
| H+濃度 | 濃い | 中間 | 薄い |
| 酸性 | 強い | 中間 | 弱い |
| アルカリ性 | 弱い | 中間 | 強い |
上記の表が示すように、酸性とアルカリ性はお互いのバランスの上で成り立っており、
酸性が 弱い ときは アルカリ性が 強い
という関係性となります。
また③式で示したように、pHが7のときpOHも7になり、酸性でもなく、アルカリ性でもない中間の状態となります。この状態を「中性」と呼びます。
なお、家庭用洗剤や温泉の表記ではpHの範囲に応じて下記のような名称が付されています。
| 液性 | pHの範囲 |
|---|---|
| 酸性 | pH < 3.0 |
| 弱酸性 | 3.0 ≦ pH < 6.0 |
| 中性 | 6.0 ≦ pH ≦ 8.0 |
| 弱アルカリ性 | 8.0 < pH ≦ 11.0 |
| アルカリ性 | 11.0 < pH |
pH測定の重要性
pHは溶けている物質や水温などによって異なります。
そして、同じ物質を溶かすときにも、液性が酸性かアルカリ性かによって溶け方が異なる場合も多々あります。
また、溶けた物質が液体の中で分解や反応を起こす過程でpHは刻々と変動します。
このようにpHは一定ではなく、反応を観察する際にも極めて重要な指標となるため、目的に応じてこまめな測定が重要となります。
